Ontdek meer over het blauwe goud!

Waterkringloop
De motor van deze kringloop is de zon. Door de zon verdampt het oppervlaktewater. Een deel valt onder de vorm van neerslag terug naar beneden en dringt in de ondergrond of wordt via rivieren naar zee gevoerd.
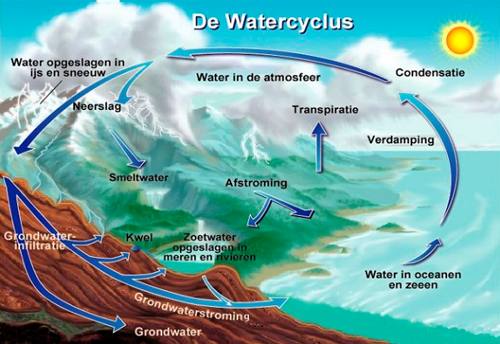
Grondwater kan eeuwen in de grond blijven en lange afstanden afleggen voor het weer aan de oppervlakte komt. Dan begint de cyclus opnieuw. Zo wordt het bestaand ecosysteem in stand gehouden. Het wonderlijke is dat geen enkele druppel van de hele hoeveelheid water verloren gaat.
Er wordt aangenomen dat de hele kringloop in een permanent dynamisch evenwicht blijft. Dit evenwicht van de waterkringloop binnen een afgebakend gebied (een rivierbekken, een waterloop, enz.) noemt men de waterbalans. Dit is het evenwicht tussen de wateraanvoer en de waterafvoer van het gebied. Deze kennis is van groot belang voor het waterbeheer.
Dit natuurlijk evenwicht kan verstoord worden door natuurfenomenen (droogteperiodes, wateroverlast, ...), maar ook door de mens. Door de snelle afvoer van neerslagwater via de riolering en door de toegenomen verharding van de ondergrond van onze woonomgeving, krijgt het water onvoldoende tijd en gelegenheid om in de ondergrond te dringen. Dit heeft dalende grondwatertafels tot gevolg.
Samenstelling
Kraantjeswater is lekker, gezond en telt geen calorieën. Kraantjeswater bevat minerale bouwstenen die je lichaam nodig heeft. Belangrijk is ook dat kraantjeswater niet té veel mineralen bevat.
Licht mineraalhoudend water
Drinkwater zorgt, naast de aanvoer van mineralen, vooral voor het zuiveren van het lichaam. Hiervoor is het belangrijk dat er niet te veel mineralen in het water zitten. De mineralen die we dagelijks nodig hebben halen we grotendeels uit andere voedingsmiddelen.
Drinkwater kan je onderverdelen volgens de hoeveelheid mineralen in het water, d.i. de zogenaamde droogrest. We onderscheiden:
- zeer licht mineraalhoudend water: tot 50 mg droogrest per liter
- licht mineraalhoudend water: tot 500 mg droogrest per liter
- gemiddeld mineraalhoudend water: tot 1000 mg droogrest per liter
- sterk mineraalhoudend water: meer dan 1000 mg droogrest per liter.
Zeer licht en licht mineraalhoudende waters mag je dagelijks drinken zoveel je wil. Je krijgt op die manier nooit een teveel aan bepaalde stoffen binnen. Met sterk mineraalhoudende waters moet je oppassen. Deze zijn niet geschikt voor dagelijks gebruik.
Pidpa-water heeft een gemiddelde droogrest van 263 mg/l en is een licht mineraalhoudend water.
Samenstelling Pidpa-water (in mg/l)
Calcium (Ca)
Calcium is nodig voor het beendergestel. Daarnaast speelt calcium ook een grote rol in tal van metabole functies. Samen met magnesium bepaalt calcium de hardheid van het kraantjeswater.
De maximumnorm voor drinkwater bedraagt 270 mg per liter.
Magnesium (Mg)
Magnesium zorgt voor de geleiding van zenuwimulsen naar de zenuwen, stimuleert de omzetting van koolhydraten en eiwitten en versterkt de spieren. De maximumnorm voor drinkwater bedraagt 50 mg/l.
Natrium (Na)
Natrium is belangrijk voor de weefselspanning en de waterhuishouding. Maar teveel zout is slecht voor de gezondheid. Een laagnatriumhoudend water is dus beter. Natrium krijg je al voldoende binnen via andere levensmiddelen onder de vorm van keukenzout.
De maximumnorm voor drinkwater is 200 mg/l. Voor zwangere vrouwen en kinderen wordt deze norm best verlaagd tot 50 mg/l.
Kalium (K)
Kalium werkt hoofdzakelijk in op de kern van de spierweefselcellen. Samen met natrium regelt het de mineralenhuishouding. Ook kalium krijg je voldoende binnen via de voeding. Er is geen maximumnorm.
Sulfaat (SO4)
Een te hoog sulfaatgehalte kan laxerend werken en op die manier leiden tot dehydratatie en irritatie van het darmkanaal. De maximumnorm voor drinkwater is 250 mg/l.
Waterstofcarbonaat (HCO3)
Waterstofcarbonaat bevordert de spijsvertering. Het neutraliseert het teveel aan zuur in het lichaam. Er is geen maximumnorm.
Chloride (Cl)
Samen met natrium is chloride verantwoordelijk voor de waterbalans in het lichaam (NaCl = keukenzout) en (als bestanddeel van de maagzuren) voor de spijsvertering. De maximumnorm voor drinkwater is 250 mg/l.
Nitraat (NO3)
Een te hoog nitraatgehalte is slecht voor de gezondheid. De maximumnorm voor drinkwater is 50 mg/l. Voor zwangere vrouwen en kinderen wordt de norm best verlaagd tot 10 mg/l.
Fluoride (F)
Fluor draagt bij tot de preventie van cariës, maar een te hoog gehalte kan zorgen voor vlekken op de tanden. De maximumnorm voor drinkwater is 1,5 mg/l. Voor kinderen wordt deze best verlaagd tot 1 mg/l.
Droogrest
Dit is het totaal gehalte aan minerale zouten. Dit bedraagt best minder dan 1500 mg/l, voor zwangere vrouwen en kinderen best minder dan 500 mg/l.
Deze cijfers zijn mediaanwaarden voor het ganse Pidpa-verzorgingsgebied. Pidpa wint haar water uit grondwater en dit op verschillende locaties in de provincie Antwerpen. De samenstelling van het gezuiverde water kan verschillen van locatie tot locatie. Het water neemt immers mineralen op uit de omringende bodem. Voor de samenstelling van het drinkwater in jouw gemeente kan je hier terecht.
Eigenschappen
Een watermolecule is de samenstelling van een groot zuurstofatoom (O) en twee kleine waterstofatomen (H). Deze atomen worden door sterke krachten verbonden.
Ruimtelijk gezien is de elektrische lading niet gelijkmatig over de molecule verdeeld. Dit maakt dat er ook een aantrekkingskracht tussen de watermoleculen onderling bestaat. Deze unieke moleculaire structuur zorgt ervoor dat water een aantal bijzondere eigenschappen heeft, waardoor het zich van alle andere stoffen onderscheidt.
Zuiver water is kleur-, geur- en smaakloos. Helderheid is een levensbelangrijke eigenschap. Ze laat verlichting onder het wateroppervlak toe, waardoor bij planten het fotosyntheseproces kan verlopen.
Water is de enige stof die onder natuurlijke omstandigheden in vaste (ijs), vloeibare (water) en gasvormige toestand (damp) voorkomt. Bij 0°C wordt het vriespunt bereikt, het kookpunt op 100°C.
De meest opvallende fysische eigenschap van water is het feit dat de densiteit (dichtheid) varieert met de temperatuur. Bij afkoeling neemt de dichtheid –net zoals bij alle andere stoffen trouwens– toe: d.w.z. het volume vermindert, het "krimpt". De densiteit is het grootst aan 4°C. Beneden 4°C vermeerdert het volume opnieuw. Het water "zet uit", wordt lichter en gaat over in ijs bij 0°C. Dit specifieke gedrag heeft belangrijke gevolgen: in de winter gaat zich een drijvende ijslaag aan het wateroppervlak vormen, die het onderliggende water beschermt tegen de strenge vrieskou.
Water heeft een uitzonderlijk oplossend vermogen. Daardoor is het een ideaal transportmiddel om voedingsstoffen naar alle delen van het organisme te brengen en afvalstoffen weer af te voeren. Het zorgt eveneens voor afkoeling. Door te zweten verliezen we immers water, waardoor onze lichaamstemperatuur op peil wordt gehouden.
Water warmt slechts langzaam op en zal die warmte ook maar traag afgeven. Anderzijds slorpt het meer warmte op dan de meeste andere stoffen. Bij hoge temperaturen gaan zeeën en oceanen, maar ook de waterdamp in de atmosfeer, een groot deel van de zonnewarmte opslaan. Daardoor zal de watertemperatuur stijgen. De waterdamp die ontstaat, zorgt ervoor dat de zon niet genadeloos brandt bij heldere hemel. Wanneer het kouder wordt, zal het water de opgeslagen warmte afgeven. Op deze manier beschermt het water ons tegen extreme temperatuurverschillen. Het mooiste voorbeeld van dit effect - of beter gezegd de afwezigheid van dit effect - is de woestijn: daar is het heet overdag en ijskoud 's nachts.
Bekijken we de viscositeit of mate van samenhang, dan merken we ook iets bijzonders. Ondanks de aanwezigheid van relatief sterke aantrekkingskrachten tussen de moleculen onderling, is water toch een beweeglijke vloeistof. Dit is het gevolg van de kleine afmeting van de watermolecule. Belangrijk is ook dat de viscositeit afneemt bij toenemende druk. Mocht water deze eigenschap niet bezitten, dan zou het slechts druppelsgewijs uit de kraan komen.
Water is vloeibaar, maar toch worden kleine diertjes en voorwerpen gedragen door het water. Dit komt door de "oppervlaktespanning", een soort buigzaam vliesje dat zich aan de oppervlakte vormt door de krachten waarmee de waterdeeltjes elkaar aantrekken. Gieten we heel voorzichtig water in een glas, dan zien we de oppervlaktespanning aan het werk. Als het glas vol is, merken we dat het wateroppervlak een beetje bol staat. De huid van het water, de oppervlaktespanning, zorgt ervoor dat het glas niet overloopt.
Kostbaar water
Water is een van de meest waardevolle, zoniet het kostbaarste van alle grondstoffen: levensnoodzakelijk en schijnbaar onuitputtelijk. Bijna niemand staat stil bij de vanzelfsprekendheid waarmee het leidingwater uit het kraantje loopt, noch bij het complex proces dat aan de continue dagelijkse levering van zuiver, helder kraantjeswater voorafgaat.
Met de productie en distributie van drinkwater gaan enorme investeringen gepaard. Permanente kwaliteitscontrole is hierbij 1 van de grootste bekommernissen. En toch is water goedkoop. Véél goedkoper dan flessenwater, liefst 50 tot 200 keer.
Van het water dat verdeeld wordt, nemen de huishoudens ongeveer 37 tot 40 % voor hun rekening. Het overige gaat naar industrie en landbouw. Daar is water een onmisbare grondstof (bvb. in bierbrouwerijen), hulpstof (bvb. in de papierfabricage), koelmiddel en spoelmiddel. Transport gebeurt nog steeds voor een deel via water. Ook de veeteler en de tuinder kunnen water niet missen, want dieren en planten zijn levende wezens die water broodnodig hebben.
In het ecosysteem 'aarde' bestaat, behalve lucht, geen tweede 'levensbron' die te vergelijken is met water. Niet olie of diamanten, maar water zal volgens velen tijdens het derde millennium uitgroeien tot het kostbaarste bezit. Met het oog op de explosief groeiende wereldbevolking -samen met de andere oorzaken van waterschaarste zoals overconsumptie, verspilling en vervuiling- voorspellen doemdenkers dat water de inzet wordt van oorlogen.
Waterschaarste
Onze aarde is een ‘blauwe planeet’. 70 % van het aardoppervlak is bedekt met water. Als de aarde vlak zou zijn, dan was ze 1 zee, 3.700 meter diep. Maar 97,5 % van het 1,4 miljard km³ aanwezige water is zeewater, en van het resterende zoetwater bestaat meer dan 2/3de uit ijs. Wat overblijft, bevindt zich ofwel op grote diepte, of is sterk vervuild. Dit betekent dat slechts minder dan 1 % onmiddellijk geschikt is voor de drinkwatervoorziening.
Recente prognoses duiden dat tegen 2025 meer dan vijftig landen, met samen drie miljard mensen, met waterschaarste zullen worden geconfronteerd.
De 5 oorzaken van waterschaarste.
1. Verdroging
De laatste jaren groeit de vrees voor een mogelijke verdroging of uitputting van onze watervoorraden. Als gevolg van natuurlijke verschijnselen of door tussenkomst van de mens, is waterschaarste plaats- en tijdsgebonden. De mate waarin water wordt verbruikt en bestaande watervoorraden zich tezelfdertijd kunnen aanvullen, zijn hierbij twee basisparameters.
Bij het winnen van water was steeds de lage productiekost een belangrijk criterium. Deze benadering had en heeft echter verregaande gevolgen: de makkelijkst te bereiken en te gebruiken watervoorraden zijn al te intensief aangesproken en uitgeput. In sommige regio’s zijn de grondwatertafels gedaald, met als gevolg infiltratie van zeewater en een onvoldoende aanvulling van de dieper gelegen grondwaterlagen. Deze evolutie verplicht ons op zoek te gaan naar diepere of meer verontreinigde watervoorraden, die de kosten van productie doen stijgen. Vooral in de ontwikkelingslanden wordt zo een hypotheek gelegd op een gecontroleerd en toekomstgericht waterbeheer.
2. Bevolkingsgroei
De groeiende wereldbevolking legt een bijkomende druk op de watervoorraden; niet alleen door het stijgend waterverbruik maar ook door de bijhorende ecologische verschijnselen. Tussen 1940 en 1990 groeide de wereldbevolking aan met meer dan 100 %; van 2,3 miljard naar 5,3 miljard. Tegelijk verdubbelde het waterverbruik per persoon. Deze twee elementen hebben tot gevolg dat in een tijdsspanne van een halve eeuw het globale waterverbruik verviervoudigde.
Nu kampen 80 landen, die 40% van de wereldbevolking vertegenwoordigen, met watertekorten. In de nabije toekomst worden ernstige problemen verwacht in grote delen van Afrika en het Midden-Oosten, Noord-China, delen van India en Mexico, het westen van de Verenigde Staten, het noordoosten van Brazilië, en de Centraal-Aziatische landen die vroeger deel uitmaakten van het Oostblok.
Een stijgende bevolking betekent een verhoogde voedsel- en brandstofproductie. Deze verhoogde productie brengt dan weer een stijgende vervuiling met zich mee door het gebruik van pesticiden en een hogere graad van bemesting en ontbossing.
3. Het ‘broeikas-effect’
De concrete gevolgen van de geleidelijke opwarming van de aarde zijn onmogelijk helemaal te voorzien. Implicaties voor de bestaande ecosystemen zijn echter onvermijdelijk. Het klimaat verandert en wijzigt de bestaande weersomstandigheden met zowel droogte als overstromingen tot gevolg.
4. Vervuiling
Vervuiling heeft vele oorzaken: residu's van industrie en landbouw, onvoldoende of afwezige afvalwaterbehandeling. De cijfers hieromtrent zijn onthutsend: de helft van de wereldbevolking heeft te kampen met ziekten, die rechtstreeks of onrechtstreeks te wijten zijn aan het gebruiken van vervuild water. Zo sterven elk jaar 5 miljoen mensen, onder wie 4 op 5 kinderen in de ontwikkelingslanden.
Deze vervuiling leidt tezelfdertijd tot een duurdere drinkwaterbehandeling. Dit betekent dat in de minder ontwikkelde landen geen (directe) oplossingen mogelijk zijn. Het gebruik van het (weinige) bruikbare water wordt dan ook verder beperkt tot de begoede klasse.
5. Onoordeelkundig of verkeerd gebruik.
Het waterverbruik in onze moderne wereld blijft stijgen. De manier waarop men verbruikt en de grootte van het verbruik zijn hierbij direct afhankelijk van het peil van de economische ontwikkeling, het klimaat en de bevolkingsgrootte. Ze verschillen van land tot land of van regio tot regio. Inwoners van het Afrikaanse continent besteden bijna 88% van hun watervoorraden aan irrigatie in de landbouw, terwijl Europeanen de helft van het beschikbare water reserveren voor industriële toepassingen en de productie van hydro-elektriciteit. In België bedraagt dit bijna 85% van de totale waterproductie.
Ook de verschillen in huishoudelijk verbruik zijn enorm. In de U.S.A. is het gemiddeld verbruik per persoon per dag 700 liter; in Senegal is dit 29 liter. Een onevenwicht dat niet meer te verdedigen valt, maar een globalisering tezelfdertijd ernstig bemoeilijkt. 1,8 tot 2 miljard mensen beschikken niet over zuiver water, terwijl er in de staat Californië (25 miljoen inwoners) alleen al 600.000 zwembaden zijn.
